

제1장 분젠버너에 불피우기
ㆍ화학 공부를 가장 어렵게 하는 방법은 우리가 알아야 할 필요가 있는 모든 것을 배우기 위해서 마지막 순간까지 기다리는 것이다. 그러나 화학의 주제를 좀 더 작고, 쉽게 소화될 수 있는 부분으로 나눈다면 화학을 이해하기가 훨씬 쉬워질 것이다.

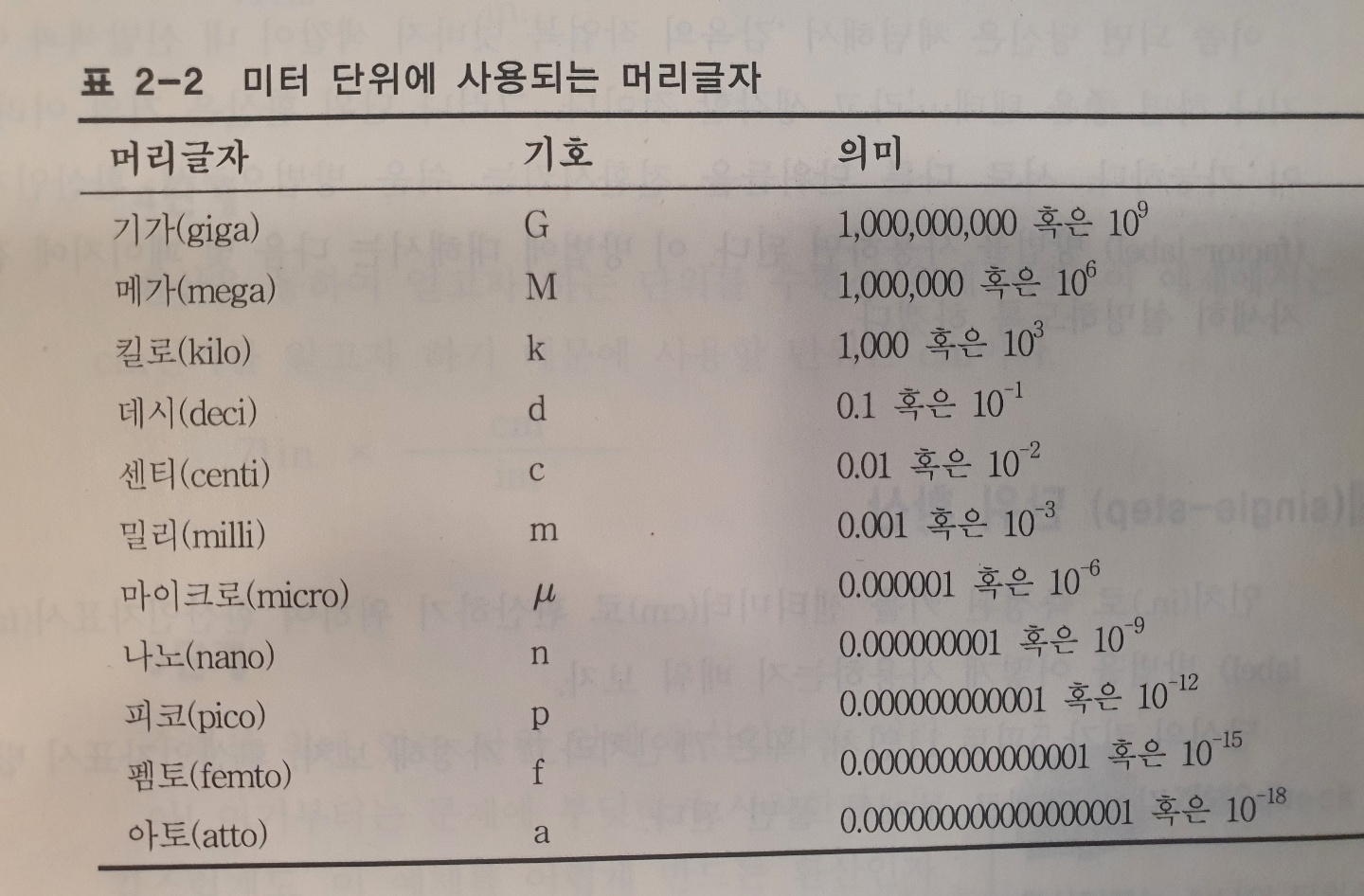
ㆍ정확도 accuracy - 측정된 데이터가 참값에 가까울 때
ㆍ정밀도 precision - 값이 여러 번 반복적으로 측정될 때 같은 값을 얻는 것
정확한 데이터는 항상 정밀하지만, 정밀한 데이터는 항상 정확하지는 않다.
ㆍ유효숫자 significant figure - 측정되거나 계산되는 것에 대한 의미 있는 정보를 주는 어떤 값을 나타내는 숫자
ㆍ과학적 방법의 단계
1) 목적
2) 가설
3) 실험 고안
4) 데이터 수집
5) 데이터 분석
6) 반복 (재시도)
ㆍ과학에서 가장 힘든 것 중 한 가지는 틀렸다는 것을 인정하는 것이다.
ㆍ오차
계통오차 determinate error: 매번 측정할 때마다 동일한 실수가 생기는 것
우연오차 indeterminate error: 실수가 제멋대로 변하는 것
ㆍ거의 2000년 동안, 물질의 성질을 발견하기 위하여 어느 누구도 실험을 하지 않았다. 그러나 18세기 말 무렵, 라부아지에의 발견으로 많은 것이 변했다. 라부아지에는 화학반응에 의하여 만들어진 생성물의 무게는 반응물의 무게와 같다는 것을 발견했다. 이것이 질량보존의 법칙 the law of conservation of mass)으로 알려져 있다. 어떠한 화학적 변화가 일어났을지라도 물질은 창조되지도 혹은 파괴되지도 않는다.
ㆍ한 개의 원자 안에 있는 양성자의 개수는 그 원자가 어떤 원소인지를 결정한다.
ㆍ동위원소는 서로 질량이 다른 동일한 원소이다. 한 원소의 모든 동위원소는 같은 수의 양성자와 전자를 갖고 있지만, 중성자의 수가 다르므로 동위원소는 다른 원자질량을 갖고 있다.
ㆍ원자번호는 원소의 양성자수
ㆍ원자질량은 양성자의 수 + 중성자의 수
ㆍ원자기호는 주기율표의 원소기호
ㆍ빛의 에너지는 그 빛의 색과 연관돼 있다. 높은 에너지- 보라색 ~ 낮은 에너지 빨간색
ㆍ전자가 핵에서 멀리 떨어져 있을수록 더 많은 에너지를 갖고 있다.
ㆍ전자가 발견될 수 있는 곳을 정확하게 예측하는 것이 불가능하다는 것을 하이젠베르크의 '불확정성의 원리 incertainty principle' 라고 한다. 이 원리에 의하면 어느 물체의 운동량과 위치를 동시에 아는 것은 불가능하다. 단지 물체가 어디 있는지, 혹은 어디로 가는지만을 알 수 있고 동시에 두 가지를 알 수는 없다.
제2장 조직의 문제
ㆍ콜로이드는 입자가 실제로 녹지 않고 다른 물질 속에 골고루 퍼져 있는 물질을 말한다.
ㆍ혼합물의 분리
1) 여과
2) 증류
3) 크로마토그래피: 붙어 있는 세기의 차이를 이용해서 혼합물을 분리
4) 추출
ㆍ모든 원소들은 가장 가까운 영족기체 원소와 동일한 전자 배치를 갖기 원하므로 전자를 잃거나 얻으려고 한다.
ㆍ1몰은 어떤 것이든지 6.02 * 10(23)개를 말한다. 몰은 원자나 분자의 단위로 사용한다.
제3장 고체, 액체, 기체
ㆍ고체는 원자나 분자들이 분자간 힘 혹은 결합에 의하여 어떤 공간에 단단하게 갇혀 있는 물질의 상태를 말한다.
ㆍ액체는 분자들이 서로 자유롭게 움직이지만 여전히 끌어당기는 힘을 가지고 있는 물질의 형태이다.
ㆍ기체는 분자들이 개개 서로 멀리 떨어져 있으며, 빠르게 움직이고, 특히 서로 끌어당기지도 않는 물질의 한 상태이다.
제4장 반응은 어떻게 일어나는가?
ㆍ활성화에너지는 반응물이 생성물을 형성하기 위하여 필요한 최소량의 에너지이다.
ㆍ가역반응은 반응물에서 생성물이 형성되고 생성물이 반응물로 다시 형성되는 반응이다. 생성물과 반응물의 농도가 안정되면 반응은 평형에 있다고 한다.
ㆍ대략, 화학반응속도는 온도가 10도씩 올라갈 때마다 약 2배씩 증가한다.
ㆍ활성화에너지는 온도에 의존하지 않는다.
제5장 화학반응
ㆍ화학적 기준에서 볼때 pH 7.001인 용액은 염기성이지만 일반적으로 pH가 7에 가까운 화합물은 중성이라고 한다.
ㆍ전기화학 과정은 전자전위가 양의 값을 가질 때에만 자발적으로 진행된다.
ㆍ유기화합물은 탄소를 포함하는 화합물로 구성되어 있지만, 산화물(CO, CO2)과 탄산화합물은 예외로 한다.
ㆍ융합반응은 작은 핵들이 결합해서 더 큰 핵과 엄청나게 많은 양의 에너지를 생산하는 핵과정이다.
제6장 열역학
ㆍ에너지는 일을 하거나 열을 발생시킬 수 있는 물질의 능력이다. 운동에너지는 운동과 관련된 에너지이며, 위치에너지는 저장된 에너지이다.
ㆍ온도는 물질 안에 있는 입자들의 운동을 나타내고, 열은 한 물체에서 다른 물체로 이동된 에너지의 양을 나타낸다.
ㆍ엔트로피는 기호 'S'로 나타낸다. 엔트로피는 계의 무질서도의 척도이다.



